
Фундаментальные и прикладные исследования в области анализа белково-пептидного состава гидролизатов белков молока и ферментированных продуктов
Введение: Ферментативная реакция расщепления белков является важным биохимическим процессом при получении белковых гидролизатов и изготовлении ферментированных молочных продуктов. Основными биологически ценными компонентами молока являются казеин, β‑лактоглобулин (β‑лг), α‑лактальбумин (α‑ла), иммуноглобулины, лактоферрин и сывороточный альбумин. Они проявляют свою активность непосредственно или после расщепления на специфические пептиды [1]. В реакции с протеолитическими ферментами из казеиновой и сывороточной фракций образуются различные биологически активные пептиды, которые оказывают эффект на иммунную, пищеварительную, сердечно-сосудистую и нервную системы. Они высвобождаются из аминокислотной последовательности исходного белка во время пищеварения в желудочно-кишечном тракте, в результате ферментации молока пробиотическими микроорганизмами или путем гидролиза протеазами in vitro. В связи с этим получили развитие технологии, позволяющие изолировать биологически активные пептиды в форме пищевых добавок. В естественном виде они присутствуют в ферментированных продуктах: йогурте, кефире, сыре и др. [2]
Расщепление белков-аллергенов молока осуществляют с использованием широкого спектра протеаз – ферментов класса гидролаз, катализирующих гидролитический разрыв пептидных связей. Изучение особенностей гидролиза белков молока специфическими протеазами, а также при совместном их воздействии направлено на установление оптимальных параметров получения частичного гидролизата с заданным пептидным составом, а также иммунохимическими свойствами как компонента продуктов специализированного питания.
Вместе с тем, перспективным является направленное использование микроорганизмов и их комбинаций с известными особенностями протеолиза, что позволит получить ферментированные продукты с предпочтительной глубиной расщепления белков молока. Известно, что большинство молочнокислых бактерий (МКБ) обладают протеиназами, локализованными в клеточной стенке (ПКС, или протеиназы клеточной стенки). ПКС осуществляют гидролиз α‑, β‑ и κ‑казеина до олигопептидов, которые поглощаются бактериальной клеткой, где осуществляется их расщепление до короткоцепочечных пептидов и аминокислот. В настоящее время разработана модель микробной деградации казеина, транспорта и расщепления пептидов, регуляции стадий протеолиза [2]. В целом, с учетом современного уровня фундаментальных исследований в области изучения очищенных ПКС (их структуры, субстратной специфичности) прикладное направление связано с определением протеолитической активности МКБ и их комбинаций, а также закономерностей расщепления казеиновой и сывороточной фракций микробными протеолитическими системами.
Цель – установление закономерностей гидролиза белков молока очищенными протеазами с различными механизмами каталитического действия, а также протеолитическими системами молочнокислых бактерий и комбинаций микроорганизмов.
Объекты и методы исследования: Объекты исследования –белки молока, очищенные протеолитические ферменты, молочнокислые бактерии и их консорциумы, протеолитические системы микроорганизмов, ферментативные гидролизаты белков молока, ферментированное молоко. В работе использованы как классические, так и современные методы физико-химического и иммунохимического анализа белков молока и их ферментативных гидролизатов: электрофорез в полиакриламидном геле, обратнофазная высокоэффективная жидкостная хроматография (ВЭЖХ), конкурентный иммуноферментный анализ (ИФА).
Результаты исследований: Для исследуемых протеаз показана различная субстратная специфичность по отношению к β‑лг, α‑ла и БСА [3]. Так β‑лг устойчив к гидролизу пепсином; в то же время папаин, термолизин, нейтраза, трипсин, алкалаза и протосубтилин эффективно расщепляют данный белковый субстрат в нейтральных и щелочных средах. Для пепсина, термолизина, трипсина, алкалазы и протосубтилина установлен протеолиз α‑ла в оптимизированных условиях. В случае БСА показана исключительная устойчивость в нейтральных и щелочных средах к расщеплению различными эндопептидазами (таблица). По данным сравнительного анализа гидролизатов нативных сывороточных белков установлено, что протеолиз β‑лг и α‑ла термолизином, трипсином и алкалазой позволяет получить белковый компонент, содержащий 92–97 % пептидной фракции со сниженной в 200–2 600 раз остаточной антигенностью (таблица). Предварительная тепловая обработка белковых субстратов в оптимизированных условиях обеспечивает возрастание степени их гидролиза алкалазой, эффективное расщепление БСА и понижение остаточной антигенностью пептидной фракции в 20–25 раз. Предложен способ получения частичного ферментативного гидролизата сывороточных белков, который может быть использован как компонент продуктов функционального питания (детского, спортивного, клинического).
Изучены особенности ферментации белкового компонента молока различными МКБ (Lactobacillus spp., Lactococcus spp., Streptococcus salivarius subsp. thermophilus, Propionibacterium sp.) и их комбинациями [4]. В качестве основных характеристик протеолитической активности (ПА) определены количество гидролизованных белков молока (уровень ПА), а также субстратная специфичность микробных протеаз. Кроме того, в случае подбора микроорганизмов в состав поливидовых заквасок и концентратов необходимо учитывать эффект совместного воздействия протеолитических систем различных бактерий на казеиновую и сывороточную фракции при ферментации молока. Сравнительная характеристика экспериментальных данных, полученных с применением альтернативных методических подходов обеспечивает наиболее полное представление об особенностях бактериального гидролиза белковых фракций молока, об уровне ПА молочнокислых бактерий различных групп и их консорциумов.
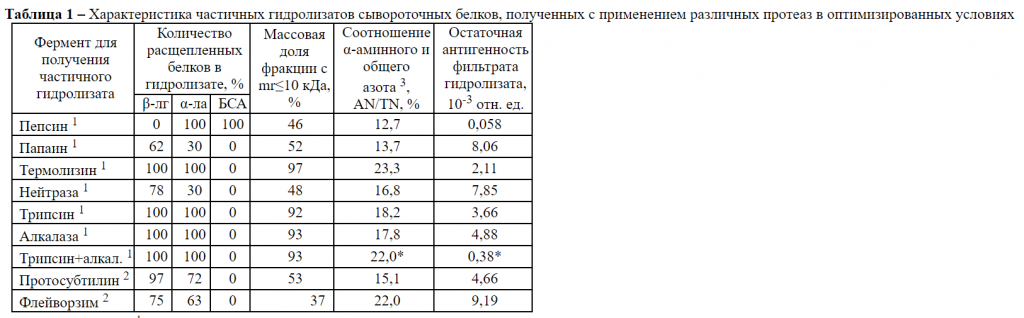
Примечание – 1 – данные по количеству расщепленных сывороточных белков в гидролизатах получены согласно электрофореза в нативных условиях и 2 – в соответствии с результатами ВЭЖХ; * – статистически достоверные различия по отношению к данным для трипсина, алкалазы (p<0,05; n=3)
Для протеолитических систем изученных штаммов мезофильных лактококков (Lactococcus lactis subsp. lactis и Lc. diacetylactis) и термофильного стрептококка (Streptococcus salivarius subsp. thermophilus) показан преимущественный гидролиз β‑казеина. Наиболее полное расщепление белков казеиновой фракции может быть достигнуто при внесении в консорциум лактобацилл или пропионовокислых бактерий. Согласно экспериментальным данным при совместной ферментации молока некоторыми термофильными лактобациллами (Lactobacillus acidophilus, Lb. helveticus) показано увеличение количества гидролизованного α‑ и κ‑казеина, что определяется сочетанием действия микробных протеаз с различной субстратной специфичностью. Установлено, что сывороточные белки не используются микробными протеазами в качестве субстрата; лишь высокоактивные ферменты изученных штаммов ацидофильной палочки способны гидролизовать основной аллерген молочной сыворотки − β‑лг. Практическая значимость проведенных исследований заключается в научно обоснованном подходе при подборе МКБ в состав заквасок и концентратов для получения ферментированных молочных продуктов с заданными параметрами: соотношением белков казеиновой и сывороточной фракций, пептидным профилем и органолептическими свойствами.
Выводы: Охарактеризована субстратная специфичность протеаз по отношению к основным белкам-аллергенам сыворотки коровьего молока (β‑лг, α‑ла и БСА); оптимизированы условия термообработки и гидролиза для расщепления всех сывороточных белков и снижения их антигенных свойств. Изучены особенности ферментации белкового компонента молока молочнокислыми бактериями (Lactobacillus spp., Lactococcus spp., Streptococcus salivarius subsp. thermophilus, Propionibacterium sp.), а также их комбинациями. Определен уровень ПА микроорганизмов и установлена специфичность действия бактериальных протеаз на белки казеиновой и сывороточной фракций.
Библиографический список:
1. Wal, J.M. Bovine milk allergenicity / J.M. Wal // Ann. Allergy Asthma Immunol. – 2004. – Vol. 93. – P. 2–11.
2. Savijoki, K. Proteolytic systems of lactic acid bacteria / K. Savijoki, H. Ingmer, P. Armament // Appl. Microbiol. Biotechnol. – 2006. – Vol. 71. – P. 394–406.
3. Головач, Т.Н. Гидролиз белков молока ферментными препаратами и протеолитическими системами молочнокислых бактерий / Т.Н. Головач, В.П. Курченко // Труд. Белорусск. гос. ун–та. – 2012. – Т. 7, Ч. 1. – С. 107–127.
4. Алгоритм исследования белково-пептидного состава кисломолочных продуктов / Т.Н. Головач [и др.] // Пищевая промышленность: наука и технологии. – 2014. – № 1. – С. 90–101.
Источник: Фундаментальные и прикладные исследования по безопасности и качеству пищевых продуктов: Сборник научных трудов VIII Международной конференции молодых учёных и специалистов. Федеральное государственное бюджетное научное учреждение "Всероссийский научно-исследовательский институт технологии консервирования". 2014. С. 58-62











