Ресурсы вторичного сырья для создания инновационной продукции
К приоритетным направлениям «Стратегии повышения качества пищевой продукции в РФ до 2030 г.» относятся обеспечение полноценного питания, профилактика заболеваний, увеличение продолжительности и повышение качества жизни населения, стимулирование развития производства и обращения на рынке пищевой продукции надлежащего качества.
Для молочной промышленности, на долю которой приходится широкий спектр и высокий удельный вес продуктов специализированного назначения, весьма актуально не только использование биологически активных веществ, но и их получение из вторичного молочного сырья. Особенно актуально на современном этапе получение минорных биологически активных белков в виде комплексов, в состав которых они входят в натуральном молоке.
Минорные и биологически активные вещества пищи – это природные вещества пищи установленной химической структуры, которые присутствуют в ней в миллиграммовых и микрограммовых количествах, не являются эссенциальными пищевыми веществами, однако играют важную и доказанную роль в адаптационных реакциях организма, поддержании здоровья, т.е. имеют установленное физиологическое действие на организм человека [1]. Наиболее хорошо изучены в рамках научной школы академика И.А. Рогова белки защитного комплекса молока (иммуноглобулины четырех классов (IgG. IgA, IgM, IgE), ангиогенин, лактоферрин, лактопероксидаза, лизоцим и их пептиды).
Ангиогенин молока – полифункциональный белок, представитель суперсемейства панкреатических рибонуклеаз. Известны три молекулярные формы ангиогенина молока: ангиогенин-1 (молекулярная масса 14,5 кДа), ангиогенин-2 (молекулярная масса ~20 кДа), лактогенин (молекулярная масса ~17 кДа). Структура ангиогенина обладает в отношении первичной структуры высокой гомологией с панкреатической РНКазой А [2], но существенно отличается от нее биологической функцией [3]. На данный период отечественными и зарубежными учеными достаточно полно описаны биологические свойства ангиогенина, основными из которых принято считать следующие: он – фактор роста кровеносных сосудов, иммуномодулятор; оказывает бактериостатическое действие; восстанавливает кристаллическую структуру крови, обусловленную нарушениями при патологиях, ингибирует синтез меланина в животной клетке, ингибирует in vitro дегрануляцию полиморфоядерных лейкоцитов (ПМЯЛ). Ангиогенин обладает специфическим свойством – цитотоксичностью. При этом ангиогенин – белок острой фазы, который вырабатывается печенью и при стрессе выбрасывается в кровяное русло вместе с другими белками острой фазы [4].
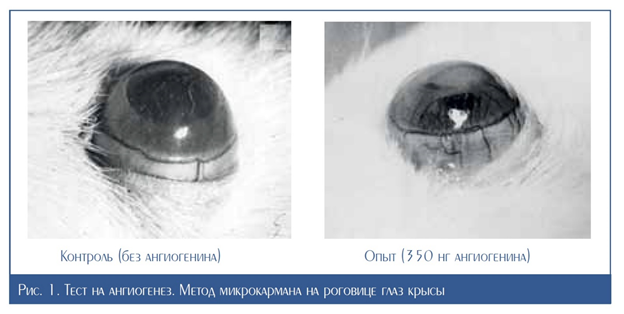
Ангиогенин – открытие конца ХХ в. Впервые белок ангиогенин был выделен в 1985 г. из культуральной среды клеток человека в Гарвардском университете США. В 1987 г. Р. Шапиро выделил ангиогенин из плазмы сыворотки крови человека, а в 1988 г. Бонд и Велли выделили ангиогенин из сыворотки крови быка. Позже он был обнаружен в коровьем молоке. Выделенный белок получил название ангиогенин от греческого слова angion – кровеносный сосуд, так как обладает способностью активно индуцировать ангиогенез – рост кровеносных сосудов (рис. 1). За последние 10 лет в результате активных исследований отечественных и зарубежных ученых определены его биохимические свойства, биологическая активность и фармакологическое действие [5, 6]. Ангиогенин оказывает биологическое и ферментативное действие уже в нанограммовых количествах. Ангиогенин – активный фактор роста, введенный в ткань с недостаточным кровоснабжением, он вызывает индуцирование роста кровеносных сосудов вплоть до возвращения ткани к нормальному состоянию. Для получения ангиогенина могут быть использованы рекомбинантные и природные источники. Рекомбинантные источники получены на основе естественного или синтезированного гена ангиогенина человека. Природные источники – плазма крови человека и быка, молоко млекопитающих. На наш взгляд, наиболее перспективным природным источником ангиогенина является вторичное молочное сырье (обезжиренное молоко, сыворотка и т.п.), которое по содержанию ангиогенина превосходит другие источники в десятки и сотни раз и при этом имеет самую низкую стоимость и большие ресурсы [7].
Ангиогенин, как активный ангиогенетик и иммуномодулятор, является предметом исследования ряда научных школ США, Германии, Японии. Эти изыскания в основном направлены на изучение рекомбинантного ангиогенина и использования его исключительно в медицинских целях.
В отличие от зарубежных школ, учеными отечественной научной школы, возглавляемой академиком д. т. н., проф. И.А. Роговым, впервые поставлена и решена важнейшая научная, практическая и социальная задача получения ангиогенина из вторичного молочного сырья и использования молочного ангиогенина не только в медицинских целях, но и в пищевых [8].
Известные источники ангиогенина разделены на природные и рекомбинатны. К числу первых относятся культуральная среда клеток карциномы человека Нт-29 и плазма крови, а также коровье молоко и вторичное молочное сырье. Рекомбинантные источники сконструированы при использовании генно-инженерной техники на основе естественного или синтезированного гена ангиогенина человека.
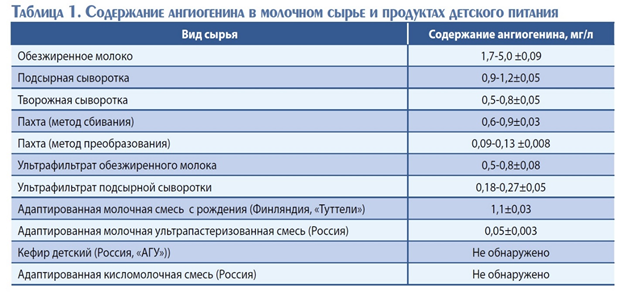
Ангиогенин содержится во многих физиологических жидкостях, а именно в молоке млекопитающих, сыворотке крови, околоплодной жидкости. В коровьем молоке и продуктах его переработки, в зависимости от зоотехнических факторов, режимов технологического процесса и других факторов, его содержится от 1 до 10 мг/л.
Содержание ангиогенина в различных видах молочного сырья, по данным Н.А. Тихомировой, и в детском питании, по данным И.И. Ионовой, представлено в табл. 1.
Ангиогенин играет важную роль в поддержании жизнедеятельности организма в норме и при патологии. Научным коллективом биотехнологов под руководством академика РАСХН И.А. Рогова (ФГБОУ ВПО «МГУПП») совместно с биохимиками (Институт Биохимии им. А.Н. Баха РАН), клиницистами (МОНИКИ им. М.Ф. Владимирского) и инфекционистами (Институт эпидемиологии им. Г.Ф. Гамалеи РАМН) проведены комплексные исследования, которые подтвердили иммуномодуляторные, протиовоспалительные, противоязвенные, антиоксидантные и бактериостатические свойства чистого препарата ангиогенина, а также в комплексе с биологически активными белками молока [9, 10, 11, 12, 13].
Препарат чистого ангиогенина, а также в комплексе с биологически активными белками молока может быть использован в целях создания новых лекарственных препаратов широкого спектра действия для лечения заболеваний различного генеза: инфаркта миокарда сердца и головного мозга, глаукомы, диабетической ретинопатии, артритов, переломов, ожогов, хронических воспалений, незаживающих язв и др.
Нашими исследованиями установлено, что ангиогенин, наряду с другими белками, входит в состав защитного комплекса молока. Одним из самых активно изучаемых и перспективных белков этого комплекса является лактоферрин, который впервые был описан в 1939 г. 1984 г. впервые была расшифрована первичная структура лактоферрина женского молока, а в 1991 г. – коровьего.
Лактоферрин – белок с молекулярной массой ~80 кДа. Он существует в двух формах: апо- и хололактоферрин (апо-ЛФ и холо-ЛФ). Лактоферрин в составе молекулы имеет два домена, связывающих трехвалентное железо с высокой эффективностью. Физиологические свойства белка в основном обусловлены связыванием с железом, и активная форма ненасыщена железом (апо-лактоферрин). Насыщенная железом форма (холо-лактоферрин) неактивна. В парном молоке содержится преимущественно до 90 % апо-ЛФ. Очень богато лактоферрином женское молоко, в котором его содержится около 1,7 г/л, а в коровьем – от 30 до 300 мг/л. Содержание лактоферрина зависит от физиологических факторов, прежде всего от стадии лактации. Больше всего его в молозиве [14, 15]. Лактоферрин преимущественно инактивирует грамотрицательные бактерии. Противовирусный эффект его реализуется через инактивацию вирусных ферментов (обратной транскриптазы, интегразы, протеазы). В организме человека и животного лактоферрин является переносчиком железа, причем более активным, чем известный белок молока трансферрин. Он активирует внутриклеточное переваривание, в том числе макрофагов – одного из значимых факторов неспецифической резистентности организма. Антиоксидантное действие лактоферрина происходит за счет связывания трехвалентного железа, ответственного за образование в водных средах высокоактивных свободных радикалов, прежде всего высокоактивного супероксидного радикала, обладающего мутагенным действием. Медико-биологические исследования, проведенные с лактоферрином человека, свидетельствуют о его противовоспалительном и антисептическом действии. Также он способствует излечению больных с онкологическими заболеваниями. Лактоферрин в чистых растворах легко можно определить, используя спектрофотометрический метод анализа холо-ЛФ. В сложных биологических системах, таких как молоко, кровь и т.п., где содержится гетерогенный состав белков, количественное и качественное определение ангиогенина затруднено. Научным коллективом, возглавляемым проф., д. б. н. Г.С. Комоловой были разработаны на основе спектрофотометрии довольно простые методы, не требующие сложного оборудования и специальной квалификации процедуры по очистке лактоферрина из молочного сырья. Применяя разработанный метод, было установлено, что апоформа ЛФ, являющаяся устойчивой к высоким температурам и низким значениям рН, хорошо сохраняется во вторичном молочном сырье, которое может быть использовано в качестве эффективного сырьевого ресурса для получения в промышленных масштабах лактоферрина.
В России ЛФ из вторичного молочного сырья в промышленных масштабах не получают. Медико-биологические и клинические испытания под руководством проф. Р.И. Якубовской проводятся на ЛФ из грудного женского молока в молозивный период лактации. Безусловно, учитывая ничтожные объемы доступного молозива от рожениц, этот источник нельзя считать целесообразным. Между тем, бычий ЛФ обладает в основном такими же, как и ЛФ человека, свойствами и может быть получен из вторичного молочного сырья, причем непосредственно, как установлено нашими исследованиями, в активной апо-форме.
На Западе лактоферрин получают из молочного сырья: молозива и подсырной сыворотки. Существует производственная линия Colostrum (фирма Colostrum lactoferrin direct). На основании биологически активных белков молока производят БАДы в широком ассортименте. Продукт продается в упаковке, содержащей 60 капсул, каждая по 250 мг. Коммерческий препарат лактоферрина характеризуется низким содержанием железа, целлюлозы и магнезии. Цена коммерческой упаковки составляет около 30 долл. В России такая продукция не производится, однако потребность в ней оценивается в размере от 0,5 до 1 млрд долл. [16].
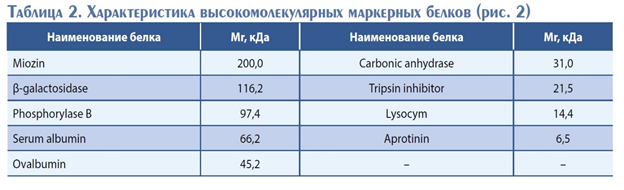
Поэтому на кафедре «Технологии и биотехнологии продуктов питания животного происхождения» ФГБОУ ВО «МГУПП» совместно с представителями ЗАО «Тбилисский МСЗ» Краснодарского края были проведены исследования по содержанию лактоферрина и панкреатических рибонуклеаз. В качестве объекта исследования использовалась подсырная сыворотка, получаемая при производстве сыра Российский молодой, произведенная по ТУ 9223-123-04610209-2002 на ЗАО «Тбилисский МСЗ» Краснодарского края. Исследование фракционного состава подсырной сыворотки производили методом SDS-электрофореза в полиакриламидном геле. Проведение электрофореза осуществляли в 16 % полиакриламидном разделяющем геле при силе тока 30–40 мА и максимальном напряжении 290 В, после чего белки окрашивали раствором краски Coumassie R-250. Для идентификации белков использовали подсырную сыворотку в 10-, 20- и 30-кратных разведениях. Электрофореграмма представлена на рис. 2.

Для идентификации молекулярных масс исследуемых белков использовали стандартные высокомолекулярные маркерные белки, характеристика которых представлена в табл. 2.
В результате проведенных исследований подсырной сыворотки, полученной при производстве сыра Российский молодой на ЗАО «Тбилисский МСЗ» Краснодарского края, определен ее фракционный состав, включающий следующие белки в порядке увеличения молекулярной массы: ангиогенин, лизоцим, β-лактоглобулин, казеиновую фракцию, лактоферрин, иммуноглобулин G.
Фракционный состав белков показал, что, наряду с хорошо изученными сывороточными белками, в исследуемом образце обнаружены уникальные биологически ценные белки, а именно: ангиогенин – специфическая рибонуклеаза, полифункциональный белок, иммуномодулятор, фактор роста кровеносных сосудов; лактоферрин – железосодержащий сывороточный белок, участвующий в метаболизме ионов железа и неспецифическом иммунитете, в частности при ингибировании патогенных микроорганизмов. Все это свидетельствует о высокой биологической ценности подсырной сыворотки, полученной при производстве сыра Российский молодой на ЗАО «Тбилисский МСЗ» Краснодарского края, и возможности ее применения не только на пищевые цели, но и как биологически ценное сырье для лечебных и косметических целей.
В последние годы большое внимание исследователей привлекают биологически активные вещества пептидной структуры, оказывающие иммунологическое действие и обладающие способностью восстанавливать иммунитет в случае его угнетения, повышающие сопротивляемость организма к инфекционным заболеваниям и неблагоприятным факторам среды. Поэтому перспективны исследования в этом направлении.
Литература
1. Мертвецов Н.П. Ангиогенин и механизм ангиогенеза / Н.П. Мертвецов, Л.Е. Стефанович. – Новосибирск: Наука. Сибирское предприятие РАН, 1997. – 78 с.
2. Strydom D.J. The angiogenins / D.J. Strydom // Cell. Mol Life Sci. – 1998. – V. 54.– № 8. – P. 811–824.
3. Шестенко О.П. Ангиогенин и его роль в ангиогенезе / О.П. Шестенко, С.Д. Никонов, Н.П. Мертвецов // Молекулярная биология. – 2001. – Т. 35. – С. 349–371.
4. Bond M. D., Vellee B.L. // Biochemistry. – 1988. – V. 27. – № 1. – P. 6283–6287.
5. Rybak S.M., Feet J.W., Yoa Q. Vallee B.L. // Biochemical and Biophysical Research Communications. – 1987. – V. 146. – № 3. – P. 1240–1248.
6. Тихомирова Н.А. Природный и рекомбинантный ангиогенин. Свойства и количественный анализ: монография. – М.: Пищевая промышленность. – 1999. – 137 с.
7. Комолова Г.С. Ангиогенин молока / Г.С. Комолова, Т.В. Фёдорова // Прикладная биохимия и микробиология. – 2002. – Т. 38. – № 3. – С. 229–236.
8. Utilization 0f biologically active proteins of milk as the bases for pharmaceutical preparations / Rogov I.F., Tikhomirova N.A., Komolova G.S., Ionova I.I., Legonkova // Веб-страница Мин-ва науки, образования и культуры Австрии. Междун. конф. биотехнология. Вена. 12–16 июня. 2005.
9. Количественное определение ангиогенина быка / И.А. Рогов, А.М. Шалыгина, Н.А. Тихомирова, Ю.Л. Рустамьян, О.В. Скоробогатько, А.М. Михайлов, Е.В. Степанова, Г.С. Комолова // Биохимия. – 1995. – Т. 60. – № 8. – С. 1344–1348.
10. Очистка ангиогенина из коровьего молока. И.А. Рогов, А.М. Михайлов, А.М. Шалыгина, Н.А. Тихомирова, Ю.Л. Рустамьян, Г.С. Комолова // Прикладная биохимия и микробиология. – 1997. – Т. 33. – № 1. – С. 107–110.
11. Определение ангиогенина в коровьем молоке на основе конкурентной пробы «Панкреатическая РНКаза / плацентарный ингибитор РНКазы-ангиогенин» / И.А. Рогов, А.М. Шалыгина, И.И. Ионова, А.М. Михайлов, Н.А. Тихомирова, Г.С. Комолова // Вопросы питания. – 1997. – № 2. – С. 35–37.
12. Титов Е.И. Глубокая переработка молока на основе биотехнологий для получения биопрепаратов / Е.И. Титов, Н.А. Тихомирова // Пищевые ингредиенты. Сырье и добавки. – 2006. – № 2. – С. 78–80.
13. Рогов И.А. Биотехнологический скрининг низкомолекулярных биологически активных белков молока препарата «МИЛКАНГ» / И.А. Рогов, Е.И. Титов, Н.А. Тихомирова // Сборник материалов научных чтений с международным участием, посвященных 100-летию со дня рождения проф. П.Ф. Дьяченко: научное издание. – М.: МГУПБ, 2006. – С. 41–42.
14. Лактоферрин: свойства и перспективы биотехнологического производства / И.Л. Гольдман, Е.С. Захарова, Р.И. Якубовская, С.Г. Кадулин, Н.В. Гнучев // Биотехнология. – 1998. – № 4. – С. 3–16.
15. Тихомирова Н.А. Биологически активные белки молока: учеб. пособие / Н.А. Тихомирова, Г.С. Комолова, И.И. Ионова. – М.: МГУПБ, 2004. – 80 с.
16. Тихомирова Н.А. Глубокое фракционирование минорных белковых компонентов из коровьего молока / Н.А. Тихомирова, Г.С. Комолова, И.И. Ионова // Переработка молока. – № 8. – 2013. – С. 60–64.
Источник: журнал "Переработка молока". 2017. № 9.

Галерея продукции
 Агар - GS900
Агар - GS900
 Заквасочный концентрат БК-Углич-СМТ для производства сметаны, сметанного продукта и простокваши.
Заквасочный концентрат БК-Углич-СМТ для производства сметаны, сметанного продукта и простокваши.
 Сепаратор для молочной сыворотки POLAT EX 3 (4 500 л/ч)
Сепаратор для молочной сыворотки POLAT EX 3 (4 500 л/ч)
 Контейнер с резьбой 600/106
Контейнер с резьбой 600/106
 Установки пластинчатые пастеризационно-охладительные универсальные для кисломолочных продуктов ПОУ-КУ (3 000 л/ч)
Установки пластинчатые пастеризационно-охладительные универсальные для кисломолочных продуктов ПОУ-КУ (3 000 л/ч)








