
Использование гидролизатов молочной сыворотки при разработке функциональных продуктов
Представлены данные по проведению гидролиза лактозы молочной сыворотки с последующим получением на ее основе гидролизата сывороточных белков с использованием приема диафильтрации. Показано, что выработанный по данной технологии гидролизат обладает повышенной массовой долей белка, минимальным количеством свободных аминокислот и пониженным содержанием лактозы.
В условиях повышенных нагрузок, стрессов, неблагоприятных экологических воздействий, характерных для современной жизни, роль питания в здоровье человека неоценима [4]. В молочной отрасли ухудшающим состояние окружающей среды является прежде всего сброс сыворотки в сточные воды, при этом многие ее компоненты являются биологически ценными и могут быть использованы при получении различных функциональных ингредиентов. В первую очередь речь идет о молочных белках, содержание которых в сыворотке может колебаться в пределах от 0,4 до 1,0 % в зависимости от ее вида и способа производства продукта [2, 3, 5]. Для придания функциональности белкам молочной сыворотки может быть применен процесс ферментативного гидролиза. Белковые гидролизаты, полученные при ферментативной конверсии молочных белков, помимо антиоксидантных, иммуномодулирующих, гипотензивных и других свойств, обладают также множеством важных функционально-технологических свойств, таких как эмульгирующая, пенообразующая и влагосвязывающая способности. Доказано, что наиболее выраженными функциональными свойствами отличаются пептиды средней длины, молекулярной массой от 3 до 10 кДа [6].
В молочной сыворотке, в частности подсырной, содержится большое количество лактозы, до 6,0 %, что может оказать значительное влияние на процесс гидролиза, как показали последние исследования. Ранее при проведении протеолиза белков сыворотки нейтральными протеазами отмечено снижение степени гидролиза при прочих равных условиях в среднем на 10 % при увеличении массовой доли лактозы на 1 %. Это говорит о том, что для получения четкого представления о молекулярно-массовом распределении гидролизатов необходимо минимизировать влияние массовой доли лактозы на процесс гидролиза.
Для гидролиза лактозы могут использоваться ферментные препараты грибкового или дрожжевого происхождения. По результатам проведенного информационного анализа выявлено, что предпочтительнее использовать β-галактозидазы дрожжевого происхождения, поскольку они более термостабильны и менее чувствительны к перепадам значений активной кислотности. Для гидролиза лактозы нами был использован препарат очищенной лактазы Maxilact («Максилакт»), являющийся продуцентом штаммов молочных дрожжей Saccharomyces (Kluyveromyces) marxianus va. Lactis.
На первом этапе осуществлялась подготовка подсырной сыворотки к гидролизу, суть которой заключалась в предварительной очистке обрабатываемой системы от жира и казеиновой пыли на сепараторе-сливкоотделителе [1]. Физико-химические показатели очищенной подсырной сыворотки, используемой для проведения гидролиза, представлены в табл. 1.
Задачей данного этапа исследований – достижение максимальной степени гидролиза при различных значениях активной кислотности среды и массовой доли вносимого фермента. Для варьирования уровня активной кислотности использовали лимонную кислоту и 20%-ный раствор NaOH. Диапазон варьирования концентраций ферментного препарата составлял от 0,04 до 0,12 %.
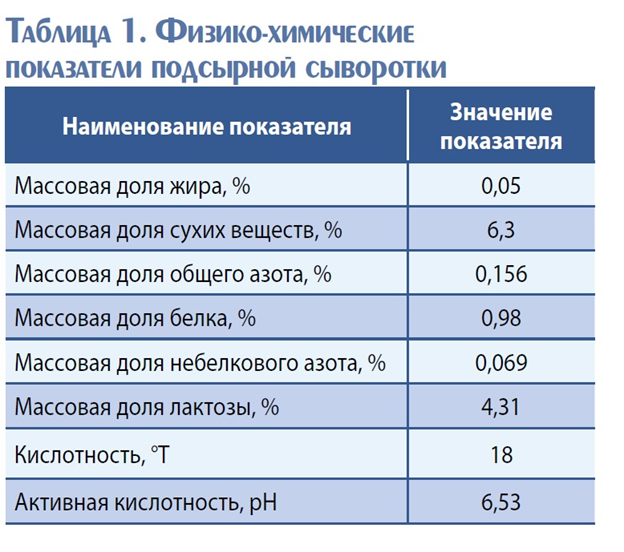
На рис. 1 представлена зависимость степени гидролиза лактозы от продолжительности процесса. На графике (рис. 1) во всех случаях прослеживается тенденция возрастания степени гидролиза с увеличением дозы ферментного препарата, при этом максимальная величина степени гидролиза отмечена при использовании дозы внесения «Максилакта» 0,12 %. Что касается степени гидролиза, то она активно увеличивается на протяжении 180 мин, далее происходит ее незначительное повышение. Это может быть связано с нарастанием активной кислотности и частичной инактивацией фермента.
На рис. 2 представлена зависимость степени гидролиза лактозы от активной кислотности сыворотки. Из данных рис. 2 можно заключить, что максимальная степень гидролиза в случае использования всех концентраций фермента при продолжительности 180 мин достигается при рН равном 6,5.
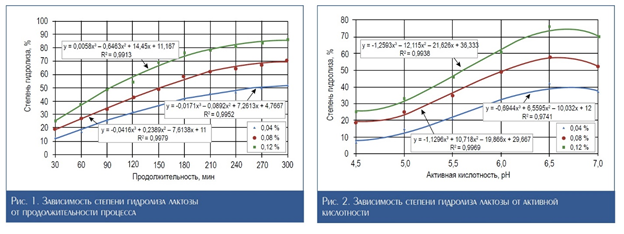
Таким образом, наиболее рациональными условиями проведения гидролиза молочной подсырной сыворотки для снижения уровня лактозы можно считать продолжительность – 3 ч, дозу внесения фермента «Максилакт» – 0,12 %, активную кислотность на начальной стадии инкубирования – не ниже 6,5 ед. рН.
Полученная на предыдущем этапе сыворотка была подвергнута диафильтрации в целях очистки от продуктов гидролиза лактозы. На первом этапе провели ультрафильтрацию до массовой доли сухих веществ 6,23 %. При этом произошла неизбежная потеря лактозы и моносахаров на 0,11 %. Для удаления из концентрата лактозы и минеральных веществ проводили однократную промывку гидролизованной сыворотки деминерализованной водой, далее осуществляли ультрафильтрационное концентрирование. Из 6 л исходного раствора был получен 1 л концентрата с содержанием белка 11,05 %. Физико-химические показатели, характеризующие процесс, представлены в табл. 2.
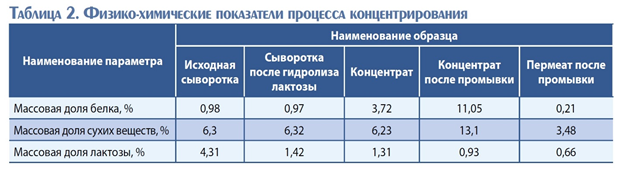
Как видно из данных табл. 2, полученный в результате гидролиза лактозы с последующей очисткой от продуктов ее гидролиза и дальнейшего концентрирования ретентат характеризуется достаточно высоким содержанием белка – 11,05 % и низким содержанием лактозы.
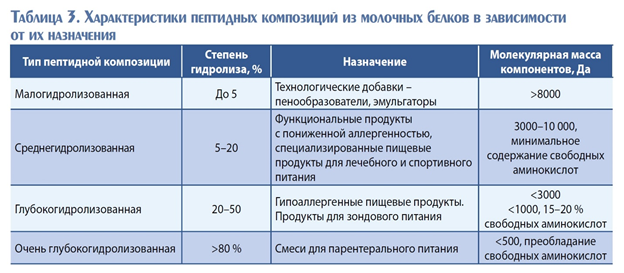
На основе ранее проведенных исследований были установлены оптимальные условия ферментативного гидролиза УФ-концентрата молочных сывороточных белков с учетом содержания белка в системе 3,5 %. В связи с тем, что полученный концентрат отличался по составу и массовой доле белка, была необходима корректировка условий проведения процесса гидролиза с учетом данных изменений. Для этого был проведен эксперимент, сутью которого явилось достижение в полученном гидролизате степени гидролиза от 10 до 20 %, при котором образуются пептиды средней длины, обладающие доказанными биологическими эффектами (табл. 3).
Суть эксперимента по корректировке условий гидролиза заключалась в изучении зависимости степени гидролиза от продолжительности процесса и зависимости содержания свободных аминокислот (САК) от продолжительности процесса.
На графике рис. 3 показаны зависимости степени гидролиза от продолжительности процесса для гидролизата, полученного на предыдущем этапе работы – ГКСБ-1 и вновь разработанного.
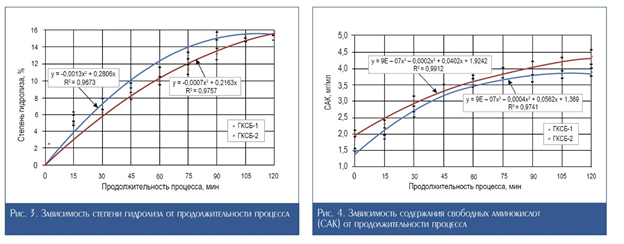
Анализируя кинетические зависимости (рис. 3), можно сделать вывод о том, что в случае получения ГКСБ-1 наибольшее значение степени гидролиза зафиксировано по истечении 90 мин, далее роста этого показателя не наблюдалось. Что касается ГКСБ-2, максимальная степень гидролиза отмечена по прошествии 120 мин процесса. Увеличение продолжительности инкубации в случае ГКСБ-2 связано с увеличением массовой доли белка в реакционной смеси, однако данный факт частично нивелируется за счет снижения лактозы более чем в 4 раза по сравнению с ГКСБ-1.
Одной из основных характеристик протеолиза молочного белка является наличие свободных аминокислот. Несмотря на то что используемые ферментные препараты по субстратной специфичности подобраны таким образом, чтобы минимизировать наличие в смеси горьких аминокислот, тем не менее большая величина САК может негативно сказаться на органолептических характеристиках гидролизата.
На рис. 4 представлена зависимость содержания свободных аминокислот (САК) от продолжительности процесса. Гидролизат ГКСБ-2 характеризуется большим по сравнению с ГКСБ-1 содержанием САК на протяжении всего эксперимента. При этом в случае ГКСБ-1 нарастание количества САК после 90 мин процесса практически не происходит, в то время как при получении ГКСБ-2 этот показатель нарастает на протяжении всего процесса.
Отсюда можно сделать вывод о том, что нецелесообразно проводить гидролиз ГКСБ-2 более 105 мин во избежание появления постороннего привкуса, поскольку по истечении этого времени достигается достаточная степень гидролиза, при которой в составе смеси прогнозируемо будут находиться пептиды средней длины.
Таким образом, при получении гидролизата по новой разработанной технологии необходимо увеличение продолжительности протеолиза на 15 мин. После получения ГКСБ-2 была проведена еще одна операция по УФ-концентрированию на мембране с порогом задержки 5 кДа в целях максимально возможного удаления свободных аминокислот. Выработанный по данной технологии гидролизат по сравнению с ранее полученным обладает повышенной массовой долей белка, сниженным количеством свободных аминокислот, пониженным содержанием лактозы. Таким образом, ГКСБ-2 может быть рекомендован для создания продуктов лечебно-профилактической направленности, в том числе и при диетотерапии лактазной недостаточности.
Литература
1. Бабенышев С.П. Баромембранное разделение жидких полидисперсных систем: монография / С.П. Бабенышев, И.А. Евдокимов. – Ставрополь: ГОУВПО «СевКавГТУ», 2007. – 123 с.
2. Доронин А.Ф. Функциональное питание / А.Ф. Доронин, Б.А. Шендеров. – М.: Грантъ, 2002. – 296 с.
3. Зябрев А.Ф. Мембранные системы «БИОКОН». Применение мембранных процессов при переработке молочного сырья. Часть 2 // Переработка молока. – 2002. – № 2. – С. 14–15.
4. Продукты быстрого приготовления на основе белковых гидролизатов животного происхождения /А.А. Торкова, И.В. Николаев, В.О. Попов, О.В. Королёва // Пищевая промышленность. – 2912. – № 7. – С. 22–25.
5. Doyen A. Use of electrodialytic reactor for the simultaneous β-lactoglobulin enzymatic hydrolysis and fractionation of generated bioactive peptides / A. Doyen, E. Husson, L. Bazinet. // Food. Chem. – 2013. –Vol. 136. – P. 1193–1202.
6. Hartman R. Food derived peptides with biological activity: from research to food applications // Curr. Opinion Biotechnol. – 2007. – Vol. 18. – P. 163–169.
Источник: журнал «Переработка молока». 2017. № 8.












